
Notre Histoire
Inventer, une vocation depuis plus d’un siècle
Oser innover pour faire progresser la santé
Depuis notre création en 1891, nous avons repoussé les frontières de la science dans l’espoir que l’avancée des connaissances scientifiques mènerait à des progrès majeurs pour toute l’humanité. Du développement des premiers vaccins contre la rougeole et les oreillons au développement de médicaments innovants dans le VIH et plusieurs cancers – pour n’en citer que quelques-uns, les femmes et les hommes de MSD ont changé le monde à plusieurs reprises à travers son histoire.

1891
Création de l’entreprise
Notre société Merck & Co., Inc. Rahway, NJ, États-Unis, a été fondée le 1er janvier 1891. George Merck, âgé de 23 ans, a créé l’entreprise aux États-Unis pour distribuer des produits chimiques raffinés dans la ville de New York et les régions avoisinantes. Merck & Co. est connu sous le nom de MSD partout en dehors des États-Unis et du Canada.

1895
Mise à disposition du 1er traitement antidiphtérique
En 1925, une terrible épidémie de diphtérie éclate et dévaste Nome, une petite ville isolée située en Alaska. La ville traverse une situation de crise, cette maladie respiratoire surnommée l’« ange étrangleur d’enfants », décime sa population. Le stock d’antitoxine diphtérique le plus proche se trouve à des centaines de kilomètres et les possibilités pour acheminer des médicaments sont alors quasi inexistantes : aucune route, ni aucune voie ferroviaire ne dessert Nome et la glace empêche les bateaux de naviguer. Le gouverneur de l’Alaska fait alors appel aux 20 meilleurs meneurs de traîneaux du service postal afin d’acheminer en urgence le sérum antitoxique de MSD. Par des températures de -45° C, ces pilotes d’attelage réussissent à parcourir les 1 085 km en un temps record de 5 jours et 7 heures. Le film d’animation Disney Pixar Balto est inspiré de cet événement, aussi appelé « Course au sérum ».

1899
Le premier manuel publié
Notre société a publié pour la première fois le livre intitulé The Merck Manual aux États-Unis en 1899 (maintenant connu sous le nom de The MSD Manual en dehors des États-Unis et du Canada). Les traitements figurant dans le premier manuel comprenaient la saignée pour la bronchite aiguë, l’arsenic pour l’impuissance et le pain aux amandes pour le diabète. Cet ouvrage est ensuite devenu l’une des références médicales les plus utilisées aux États-Unis, ce qui lui vaut le surnom de « Bible du médecin ».

1925
George W. Merck devient Président de notre entreprise
Le fils de George Merck, George W. Merck commence sa carrière dans le département d’emballage et d’expédition en 1914 et reçoit une formation dans la plupart des branches de l’entreprise. Il dirige notre société lors de la fusion de 1927 avec Powers-Weightman–Rosengarten Co. et se consacre au développement de nos activités de recherche, renforçant ainsi la réputation de notre Groupe comme entreprise pharmaceutique innovante.

1933
Création du premier laboratoire de recherche
Le laboratoire Merck Research Laboratories est fondé à Rahway dans le New Jersey. La création de ce laboratoire marque le lancement d’une activité de recherche pharmacologique pour MSD. MRL comprend alors trois divisions distinctes : la recherche fondamentale, l’Institut de recherche thérapeutique et la recherche appliquée.

1936
Synthétisation de la vitamine B1
En 1936, nos chercheurs ont synthétisé la vitamine B₁ et publié les résultats dans le Journal of the American Chemical Society. Ce développement a permis la production de masse de la vitamine, et en quelques années, le produit a contribué à la réduction de la carence en vitamine B₁ (béribéri). Au cours des années suivantes, nos équipes ont décidé d’isoler et de synthétiser des vitamines et de les rendre plus largement disponibles.

Années 1940
Découverte et distribution de la streptomycine, un antibiotique révolutionnaire.
La tuberculose était historiquement l’une des principales causes de décès aux États-Unis et en Europe. En 1943, les docteurs Selman Waksman et Albert Schatz ont découvert la streptomycine, le premier traitement efficace contre la maladie. Notre entreprise avait soutenu le laboratoire de recherche du Dr Waksman et détenait les droits de brevet. Afin de répondre au besoin urgent de traitements, nous avons renoncé à notre brevet sur l’antibiotique pour permettre un accès plus large aux patients.
En 1950, les décès liés à la tuberculose aux États-Unis avaient diminué de près de 50 %.

1942
Première production de la pénicilline
Alors que la seconde guerre mondiale faisait rage, des projets de partenariats publics-privés visant à accélérer la production de masse de pénicilline se sont développés. Notre entreprise était très impliquée dans ces projets et nous collaborions étroitement avec des laboratoires pharmaceutiques concurrents ainsi qu’avec des scientifiques de l’université d’Oxford pour mettre au point le produit qui faisait alors cruellement défaut. Cette même année, nous avons envoyé en urgence 4,18 milliards d’unités de pénicilline, le premier antibiotique efficace sur les champs de bataille de la seconde guerre mondiale, contribuant ainsi à la survie de milliers de personnes.

1948
Arrivée sur le marché de la santé animale avec la sulfaquinoxaline.
Après des années de tests approfondis, nous commercialisons la S.Q. (sulfaquinoxaline). Ce produit, utilisé pour prévenir la coccidiose, une maladie parasitaire de la volaille, nous a permis d’entrer officiellement sur le marché de la santé animale.

1950
Première synthèse de la cortisone
Le Dr Lewis Sarett, chercheur à Rahway, a mis au point CORTONE (cortisone). Le médicament était utilisé dans le traitement de l’arthrite rhumatoïde, du rhumatisme articulaire aigu et d’autres maladies chroniques connexes, souvent mortelles, pour lesquelles il n’existait aucun traitement efficace connu.

1950
Les médicaments sont pour les patients
À un moment décisif pour notre entreprise, George W. Merck donne une conférence au Medical College of Virginia à Richmond, au cours de laquelle il fait une déclaration célèbre sur la manière dont la communauté médicale et pharmaceutique peut prospérer :
“Nous essayons de ne jamais oublier que les médicaments sont pour les patients, et non pour les profits. Ceux-ci suivront, et si nous respectons ce principe, ils seront toujours là.“
Cette philosophie est adoptée par tous nos collaborateurs à ce jour.

1953
Fusion avec Sharp & Dohme
La fusion visant à créer Merck Sharp & Dohme (MSD) – dont le siège social est situé à Rahway, New Jersey, États-Unis – a permis de réunir nos vastes sites de recherche et de fabrication de produits chimiques avec le développement pharmaceutique, l’expertise en marketing et la présence internationale de Sharp & Dohme. Les installations de Sharp & Dohme à West Point, en Pennsylvanie, ont été incluses dans la fusion.

1957
Création de la Fondation
En 1957, nous avons créé notre Fondation d’entreprise, une société à but non lucratif dédiée aux dons de bienfaisance, avec une contribution initiale de 500 000 dollars. À ce jour, notre Fondation a versé des centaines de millions de dollars à des organismes sans but lucratif.

1958
Lancement de DIURIL pour traiter l’hypertension artérielle
Le lancement de DIURIL (chlorothiazide) a marqué l’émergence de l’entreprise en tant que leader dans le domaine cardiovasculaire. Depuis le lancement de DIURIL, nous sommes à la pointe du développement de nouveaux traitements pour lutter contre l’hypertension artérielle et les maladies cardiaques. Le “Diuril Man”, une figurine en plastique transparent représentant le cœur, les poumons, les reins, les uretères et la vessie, nous a aidé à montrer aux médecins la valeur de ce produit révolutionnaire.

1971
Le vaccin ROR
Nous avons commencé à distribuer un vaccin combiné rougeole-oreillons-rubéole (ROR), mis au point par les docteurs Maurice Hilleman et Eugene B. Buynak. Le ROR était composé de trois vaccins : ATTENUVAX, une version actualisée du vaccin contre la rougeole de MSD ; MERUVAX, un vaccin contre la rubéole ; et MUMPSVAX, le vaccin contre les oreillons de MSD.
1977
Le premier vaccin contre la pneumonie est approuvé
En 1977, PNEUMOVAX (vaccin polyvalent antipneumococcique), le vaccin contre la pneumonie de MSD, a été approuvé. La recherche et le développement du vaccin ont été effectués sous la direction du Dr Maurice Hilleman.
1978
La FDA approuve la Méfoxine
La MEFOXINE était indiquée pour le traitement de nombreuses infections causées par certaines bactéries, y compris les agents pathogènes à Gram positif et à Gram négatif.
1985
VASOTEC approuvé par la FDA
VASOTEC (énalapril), un inhibiteur de l’enzyme de conversion de l’angiotensine (ECA) pour le traitement de l’hypertension artérielle et de l’insuffisance cardiaque congestive, a été approuvé par la FDA.

1986
Le vaccin contre l’hépatite B est approuvé par la FDA
Notre vaccin recombinant contre l’hépatite B, RECOMBIVAX HB [vaccin contre l’hépatite B(recombinant)], a été approuvé par la FDA. Il s’agit du premier vaccin recombinant à usage humain. En 1989, nous avons transmis la technologie du vaccin RECOMBIVAX HB au gouvernement chinois, où l’hépatite B était le plus grand enjeu de santé publique du pays, avec environ 100millions de porteurs de la maladie.

1987
Mise à disposition de la première statine commerciale
Nous avons lancé la lovastatine, le premier médicament de la famille des statines à être approuvé par la FDA. Elle est le fruit de décennies d’études menées par des scientifiques, dont les nôtres, dans le monde entier.

1987
MSD s’est engagé à donner du Mectizan – autant que nécessaire et aussi longtemps que nécessaire – dans le but d’éliminer la cécité des rivières.
En 1987, le Dr Roy Vagelos, PDG de MSD, a annoncé annoncé notre engagement à donner du Mectizan – autant que nécessaire et aussi longtemps que nécessaire – dans le but d’aider à éliminer la cécité des rivières. Pour atteindre cet objectif, nos dirigeants ont reconnu que de nombreuses organisations aux compétences uniques devaient travailler en équipe. C’est ainsi qu’est né le programme de don de
Mectizan (Mectizan Donation Program), un partenariat public-privé novateur qui a influencé le développement d’autres programmes de dons de médicaments.

1996
Découverte et mise à disposition de la deuxième anti-protéase dans le VIH/SIDA (Crixivan ®)
CRIXIVAN (sulfate d’indinavir), pour le traitement du VIH, a été approuvé par la FDA après une période d’examen record de 42 jours. Avant l’approbation de la FDA en 1995, en collaboration avec la Food and Drug Administration américaine, les patients et les groupes de défense du VIH, nous avons décidé de mettre en place le programme Crixivan. Grâce à ce programme, nous avons mis gratuitement le médicament à la disposition de certains patients avant qu’il soit disponible sur le marché.

2006
Lancement du premier inhibiteur de la DPP-4, nouvelle classe d’antidiabétique oral (Januvia®)
La FDA a approuvé JANUVIA (sitagliptine), un inhibiteur pour les patients diabétiques de type 2. Le diabète touche 420 millions de personnes dans le monde et le diabète de type 2 est une maladie à croissance rapide. C’est pourquoi l’approbation de Januvia (sitagliptine) en 2006 a immédiatement été saluée comme l’arrivée d’une nouvelle option thérapeutique. Près de dix ans plus tard, Januvia est devenu l’un des médicaments les plus prescrits au monde.

2006
Découverte et production du premier vaccin contre le cancer du col de l’utérus (Gardasil®)
La FDA a approuvé GARDASIL, vaccin quadrivalent contre le virus du papillomavirus humain (types 6, 11, 16, 18) [recombinant], pour la prévention du cancer du col de l’utérus causé par certains types de HPV.
En 2007, nous nous sommes engagés à faire don de 3 millions de doses de GARDASIL sur 5 ans pour soutenir les programmes de vaccination dans les pays défavorisés.

2007
Découverte et mise à disposition du premier inhibiteur de l’intégrase du VIH
En 2007, nous avons renforcé l’arsenal thérapeutique contre le VIH en mettant à disposition ISENTRESS (raltégravir), le premier inhibiteur d’intégrase développé pour le traitement de l’infection par le VIH-1. Cette nouvelle option thérapeutique a permis d’offrir un recours aux patients qui présentaient une résistance aux traitements existants.

2009
Fusion avec Schering-Plough
MSD et Schering-Plough ont fusionné et ont commencé à combiner leurs activités. Cette acquisition a fait de l’entreprise la deuxième plus grande société pharmaceutique des États-Unis en termes de revenus.

2011
Début de l’initiative mondiale MSD For Mothers
En 2010, une femme mourrait toutes les deux minutes pendant l’accouchement et la grossesse. Nombre de ces décès auraient pu être évités. En réponse, nous avons lancé MSD for Mothers, une initiative mondiale avec des partenaires pour améliorer la santé et le bien-être des femmes avant, pendant et après la grossesse et l’accouchement. Depuis sa création, ce programme a permis d’aider plus de dix millions de femmes dans le monde, dans 48 pays.

2014
BRAVECTO approuvé par la FDA pour la division MSD Santé Animale
La FDA a approuvé BRAVECTO (fluralaner), les premiers comprimés à mâcher pour chiens dont il a été démontré qu’ils tuent les puces et plusieurs espèces de tiques pendant 12 semaines en une seule dose.

2014
MSD a reçu une approbation accélérée de KEYTRUDA (pembrolizumab)
La FDA a approuvé KEYTRUDA (pembrolizumab), le premier traitement anti-PD-1 (Programmed cell death 1 ). Il avait auparavant reçu la désignation de thérapie révolutionnaire par la FDA.

2015
Création du fonds MSDAVENIR
En 2015, nous annonçons la création de MSDAVENIR, un fonds de soutien à la recherche dans les sciences du vivant. Grâce à une première dotation de 75 millions d’euros, MSDAVENIR a apporté son soutien à 61 projets ambitieux portés par certaines des meilleures équipes de recherche en France et a permis à 8 brevets et plus de 180 publications scientifiques de voir le jour. En 2021, MSDAVENIR a renouvelé son engagement en portant sa dotation globale à 117 millions d’euros afin de renforcer son empreinte en matière de recherche et développement en France et de contribuer à décloisonner la recherche scientifique au travers de partenariats public-privé.
2017
Lancement d’un traitement préventif de la réactivation du cytomégalovirus (CMV)
Nous avons mis à disposition une innovation pour la prévention de la réactivation du cytomégalovirus chez les patients adultes receveurs d’une greffe allogénique de cellules souches, en prophylaxie dans la prévention de l’infection à cytomégalovirus (CMV) chez les adultes séropositifs au CMV, allogreffés de cellules souches hématopoïétiques (GCSH). Ce traitement a permis de protéger ces patients greffés qui sont vulnérables.
2018
Mise sur le marché de deux traitements antirétroviraux
La FDA a approuvé deux nouveaux médicaments dans la prise en charge des infections par le VIH. Ces traitements à base de doravirine, une molécule innovante de par son efficacité et sa simplicité de prise, permettent aujourd’hui d’améliorer la qualité de vie des patients. En 2020, MSD a conclu avec deux fabricants de génériques des contrats de licences volontaires non exclusives permettant l’enregistrement, la commercialisation et la distribution de la doravirine génériquée, seule ou en STR, dans plus de 80 pays.
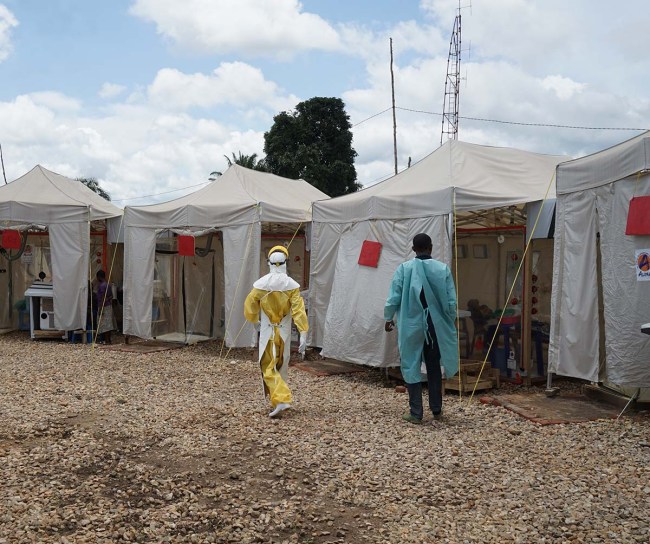
2019
ERVEBO® approuvé par la FDA
De la Guinée à la République démocratique du Congo (RDC), le monde était confronté aux épidémies d’Ebola les plus importantes et les plus complexes depuis la découverte du virus en 1976. Alors que les épidémies étaient un défi sanitaire mondial, les scientifiques de MSD, ainsi que de nombreux partenaires externes de tous les secteurs, ont joué un rôle de premier plan dans la réponse apportée aux épidémies de cette maladie mortelle.
MSD a reçu l’approbation de la FDA pour ERVEBO® (vaccin vivant contre le virus Ebola Zaïre) pour la prévention de la maladie causée par le virus Ebola Zaïre chez les personnes âgées de 18 ans et plus.
FR-CMM-00652 – Mars 2024

